Цели и задачи урока.
Дидактические:
- Обобщить и систематизировать знания учащихся о Периодическом законе химических элементов Д. И. Менделеева, о строении Периодической системы химических элементов, об изотопах, об естественных семействах химических элементов, о строении атомов, амфотерных соединениях.
- Продолжить формирование умений и навыков характеризовать элемент по его положению в Периодической системе.
- Закрепить умения и навыки в решении задач на нахождение неизвестного элемента, а также задач на вычисление относительной атомной массы элемента по процентному содержанию в природе всех нуклидов данного элемента.
- Продолжить закрепление умений и навыков в составлении уравнений химических реакций, иллюстрирующих амфотерный характер оксида или основания.
- Закрепить навык в определении количества элементарных частиц, входящих в атом конкретного нуклида элемента.
- Продолжить формирование навыков и развивать умения обращения с лабораторным оборудованием, химическими реактивами.
- Развивать логическое мышление, умения анализировать и систематизировать, обобщать.
- Развивать познавательный интерес к химии.
- Формировать научное мировозрение.
Психологические:
- Всестороннее развитие личности.
- Развитие личности ребенка, основанное на его возможностях, склонностях, интересах.
- Развитие творческих способностей.
- Максимальное вовлечение каждого ученика в образовательный процесс.
Воспитательные:
- Воспитывать чувство уважения к своему труду, к труду товарищей, к работе учителя.
- Развивать требовательность к себе и разумную требовательность к окружающим людям.
- Прививать аккуратность, бережливость, разумную осторожность при обращении с лабораторным оборудованием и химическими реактивами.
- Воспитывать чувство коллективизма.
Межпредметные связи урока:
- Физика.
- Математика.
- Литература.
Оборудование и реактивы.
- Штатив для пробирок с двумя пробирками – 2 шт.
- Раствор нитрата алюминия (
Дидактический материал, таблицы:
- Периодическая система химических элементов Д. И. Менделеева.
- Портрет Д. И. Менделеева.
- Карточки с заданиями.
Ход урока
І
. Вступление.Учитель:
“Мир сложен,
Он полон открытий, сомнений
И тайн бесконечных, и
смелых догадок –
Как чудо природы
Является Гений –
И в хаосе этом наводит
порядок”.
Эти строки написаны о великом русском ученом Д. И. Менделееве (показывает на портрет ученого). Он является автором, первооткрывателем одного из самых фундаментальных законов природы - Периодического закона, с которым мы с вами ознакомились на предыдущих уроках.
Вопрос ученикам: Какие темы, понятия мы изучили с вами, чему научились, что закрепили? (ответы учеников).
Учитель: На прошлом уроке мы подвели итог в виде письменной зачетной работы по карточкам. Результаты ее таковы… (Сообщает результаты зачетной работы, дает краткий общий анализ). И в виду важности этой темы для всей химии и естественных наук, сегодня мы проведем итоговый урок обобщения, систематизации и коррекции знаний, умений и навыков. Чтобы каждый из вас мог проявить себя, привести в порядок, в систему свои знания и мог помочь своим одноклассникам, а урок прошел творчески, мы проведем урок-соревнование. И я бы дала этому уроку 2 девиза: (написаны на досках заранее и открываются, и зачитываются учителем)
Девиз № 1: “Один за всех и все за одного!”
Девиз № 2: “Бороться и искать, найти и не сдаваться!”
ІІ. Жеребьевка.Каждое соревнование предполагает соперничество двух или болем
команд, и мы сейчас образуем эти две команды с помощью жеребьевки. Ее условия таковы: вы достаете карточку с номером элемента и определяете, в какой подгруппе Периодической системы расположен данный элемент: если это главная подгруппа, то вы участник команды № 1; если побочная - № 2.Карточки с номерами элементов:

Пересядьте на первый ряд члены команды № 1, на второй ряд – команды № 2. (Рассаживаются по одному за парту). С собой возьмите ручку и Периодическую систему, которой вы привыкли пользоваться или в дневнике, или в учебнике, или в опорном конспекте или т. п.
ІІІ. Ознакомление с оценочными листами:У вас, у каждого на парте лежит оценочный лист. Напишите на нем свою фамилию и в колонке “Самооценка” поставьте оценку своим знаниям и умениям, которыми вы овладели, изучая І часть темы “Периодический закон и Периодическая система химических элементов Д. И. Менделеева”. Вам сегодня предстоит принять участие в конкурсах.
Образец оценочного листа ученика.
Фамилия, имя участника соревнования, название команды |
Само- оценка |
Конкурсы |
Итог |
||||
I (1б) |
II (2б) |
III-V (3б) |
VI (3б) |
VII (2б) |
|||
| команда | |||||||
Правила соревнований:
- Каждый участник соревнований получает оценку за конкурсы.
- Суммарный балл – итоговая оценка за урок ученика.
- Участники победившей команды получают по 1 баллу плюс к итоговой оценке.
- Оценка команды за конкурс – средний балл из оценок участников данной команды.
- Максимальный балл ученика 11 баллов, при победе команды – 12б.
І
конкурс.“Назови команду” (конкурс разгадывания кроссвордов).
Каждой команде дается кроссворд, участники отгадывают по одному слову и передают дальше – ключевое слово – название команды.
І команда – ключевое слово “Изотопы”.
ІІ команда – ключевое слово “Нуклиды”.
І команда.

- Название элемента, расположенного в ІІІ малом периоде, во ІІ группе, главной подгруппе.
- В центре атома находится ядро, которое имеет положительный … .
- Ряд элементов, расположенных по увеличению заряда ядра, который начинается щелочным (активным) металлом и заканчивается активным неметаллом (галогеном) и инертным газом.
- Положительная частица ядра.
- Центральная часть атома.
- Ряд элементов с похожими свойствами, у которых одинаковая максимальная валентность.
- Естественное семейство элементов – VII группа, главная подгруппа.
ІІ
команда.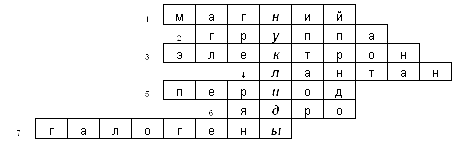
- Название элемента, расположенного в ІІІ малом периоде, во ІІ группе, главной подгруппе..
- Ряд элементов с похожими свойствами, у которых одинаковая максимальная валентность.
- Отрицательно заряженная частица атома.
- Элемент, название которого дало название семейству. Он расположен в VI периоде.
- Ряд элементов, расположенных по увеличению заряда ядра, который начинается активным (щелочным) металлом и заканчивается активным неметаллом (галогеном) и инертным газом.
- Центральная часть атома.
- Естественное семейство элементов – VII группа, главная подгруппа.
Каждый участник команды отвечает на два вопроса, передавая друг другу по цепочке, а последний участник дает определение понятию, которому соответствует ключевое слово.
За каждый правильный ответ ученик получает 0,5 б, всего 1 балл (записывает результат в оценочный лист).
Учитель. Итак, названия командам даны, переходим к следующему конкурсу
ІІ конкурс. “
Расскажи мне обо мне”.Одним из основных умений, которые вы стремились приобрести – это умение давать характеристику химическому элементу по его положению в Периодической системе. Вы получаете карточку с № элемента, характеристику которого вам нужно будет указать. Но перед этим напомним, что нужно указать в данной характеристике. Каждый ученик дает по одному ответу по цепочке.
Характеристика элемента (план).
- №, название.
- Заряд ядра, количество протонов, электронов, нейтронов.
- Период.
- Группа.
- Подгруппа.
- Максимальная валентность.
- Высший оксид, характер.
- Летучее водородное соединение.
- Сравнение Ме или неМе свойств.
Выполненное правильно задание -2 балла.
Ученики получают задание – это карточки с № элементов, которые использовались для проведения жеребьевки.
(Выполнение задания 5 минут на этих карточках с другой стороны).
Ученики выполненное задание кладут на край парты, чтобы учитель мог проверить.
Учитель. Обычно в любой команде четко распределяются обязанности между ее членами. Выберите, посовещавшись, кто из вас примет участие в конкурсе экспериментаторов и в конкурсе решения задач. (Ребята-участники получают задания).
ІІІ
конкурс. Конкурс экспериментаторов.І команда.
Получите из соли и докажите с помощью характерных реакций амфотерный характер гидроксида алюминия.ІІ команда.
Получите из соли и докажите с помощью характерных реакций амфотерный характер гидроксида цинка.(Ученики получают инструкцию по выполнению этого задания – см. Приложение).
Правильно выполненное задание – 3 балла.
Учитель. Следующие участники принимают участие в конкурсе по решению задач.
ІV конкурс. “К сияющим вершинам”.
І команда.
Элемент расположен в VIIгруппе Периодической системы. Относительная молекулярная масса его высшего оксида 183. Найти элемент.ІІ команда.
Элемент образует летучее водородное соединение, относительная молекулярная масса которого равна 81. Элемент расположен в VI группе. Определите элемент.(Ребята выполняют задание у доски).
Правильно выполненное задание – 3 балла.
Учитель. Пока ребята выполняют задания, для вас предлагается следующий конкурс, который называется “Наглая ложь”.
V
конкурс. “Наглая ложь”.В предложенных утверждениях некоторые факты искажены. Найдите ошибки и исправьте их.
Задание.
- 1. Периодический закон был открыт в 1890 году.
- 2. В периодической системе 7 периодов.
- 3. У изотопов одного элемента одинаковая атомная масса.
- 4. Каждая группа делится на главную и неглавную подгруппы.
- 5. Максимальная валентность элемента равна номеру периода, в котором расположен элемент.
- 6. Металлические свойства элементов увеличиваются слева направо.
Правильные ответы:
- 1861
- все верно
- разная
- побочную
- группы
- уменьшаются.
Каждый вопрос 0,5 б. всего за правильно выполненное задание 3 балла.
Учитель в это время проверяет характеристики элементов.
Затем подводятся итоги конкурса экспериментаторов и “К сияюшим вершинам”. Результаты ученики записывают в оценочные листы. Средний балл каждой команды записывается на доске в “Экран соревнования”.
Учитель. Переходим к выполнению следующего задания. Следующий конкурс.
VI
конкурс. “Дешифровщик”.- Вам предложена шифрограмма, в которой зашифрован порядковый номер элемента, предсказанного Д. И. Менделеевым.
- А существование скольких элементов и каких предсказал Д. И. Менделеев на основании своего закона?
- Для того, чтобы найти, какой из этих элементов зашифрован, вам нужно обвести (найти) цифры, которые соответствуют правильному утверждению, и подсчитать сумму цифр, которые в этих же клетках записаны в отдельных квадратиках.
Сумма цифр равна порядковому номеру “спрятанного” элемента.
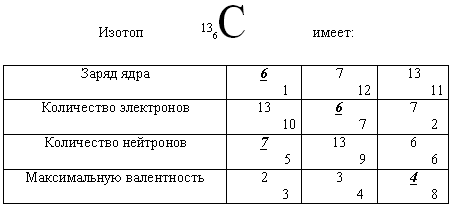
Правильные ответы в примере подчеркнуты.
Сумма цифр:
![]()
Порядковый номер элемента 21 – это Sc(скандий)
Критерии оценивания:
Каждый правильный ответ – 0,5б ? всего 2 балла. Отгаданный зашифрованный элемент – 1балл.
Всего 3балла
Проводится совместное оценивание работ соперниками. Для этого работы передают друг другу. Результаты выставляются в оценочный лист и заносятся на экран соревнование.
Учитель. Подходит к концу наш игровой урок. Вас ожидает итоговый конкурс.
VII
конкурс – конкурс “юных Знатоков”.Учитель зачитывает вопросы, ученики пишут ответ:
- элемент III группы, главной подгруппы, II периода (В-бор);
- самый активный металл III периода (Na – натрий);
- самый активный неметалл (F – фтор);
- высшая валентность элемента №15 (V);
- у какого элемента лучше выражены металлические свойства №19 или №20 (№19);
- количество электронов в атоме элемента №85 (85).
Правильно выполненное задание 2 балла.
Выставляют оценки в оценочный лист, подводят итог.
Учитель. Подведем итог нашему соревнованию. Победила команда ___________. Игроки получают +1 балл к итоговой оценке.
Заключительная часть урока, подведение итогов.
Учитель. Как вам понравился урок? Удалось ли вам в полной мере показать свои знания, умения и навыки? Смогли ли вы уяснить непонятые вами разделы данной темы?
Заканчивая урок, хочу сказать, что мы приходим к изучению II части этой важнейшей темы, а она перед вами откроет ещё большую глубину закона, о которой, сам Менделеев не знал, но догадывался, что ещё много открытий на основании закона будет сделано. Он писал “Периодическому закону будущее не грозит разрушением, а только надстройки и развитие обещает”.
И очень лирически эта мысль выражена в стихотворении М. Глазкова “Таблица Менделеева”:
“Пусть в зимний день с метелями
Не навещает грусть
Таблицу Менделеева
Я знаю наизусть
Зачем её я выучил?
Могу сказать зачем,
В ней стройность и величие
Любимейших поэм.
Без многословья книжного
В ней смысла торжество,
И элемента лишнего
В ней нет ни одного
В ней пробужденья дерева
И вешних льдинок хруст
Таблицу Менделеева
Я знаю наизусть! ”
Конечно наизусть таблицу Менделеева знать не нужно, но понимать величайший закон природы – Периодический закон химических элементов должен современный, думающий, образованный и воспитанный Человек!
Литература.
- П.П. Попель, Л.С. Крикля “Химия 8 класс” - Киев. Издательский центр “Академия” 2008.
- “Химия в школе ” 1993, №2
- А.Д. Шукайло “Тематические игры по химии”, Москва “Творческий центр “Сфера” - 2003.
- А.А. Тыльдсепп, В.А. Корк “Мы изучаем химию”, Москва “Просвещение”, 1988.
Названия конкурсов, сумма баллов, критерии оценивания
Название конкурса, время |
Участники |
Баллы |
Критерии оценивания |
| 1. Конкурс кроссвордов “Назови команду” 5 минут | Команда, каждый участник отгадывает по 2 слова и передает по цепочке |
1 балл |
1.Точность ответа 2.Одно отгаданное слово 0,5 балла |
| 2. Конкурс “Расскажи мне обо мне” (характеристика заданного элемента по его положению в Периодической системе) 5 минут | Команда, у каждого участника свое задание |
2 балла | 1.Правильность и полнота ответа |
| 3. Конкурс экспериментаторов (свойств амфотерных веществ) 5 минут | 1 человек |
3 балла | 1.Выполнение эксперимента. 2.Составление уравнений химических реакций. 3.Объяснения, выводы |
| 4. Конкурс “К сияющим вершинам” (решение задач) 5 минут | 1 человек |
3 балла | 1.Правильность решения. 2.Полнота теоретического пояснения. |
| 5. Конкурс “Наглая ложь” (по строению Периодической системы) 3 минуты | Оставшиеся участники, без тех, кто участвует в конкурсах № 3, 4 |
3 балла | 1.Правильность исправлений. 2.Колличество найденных “ошибок”. 3.Каждое предложение -0,5балла. |
| 6.Конкурс “Дешифровщик” 3 минуты | Команда, у всех одинаковое задание |
3 балла | 1.Каждое положение -0,5б. 2.Найден зашифрованный элемент -1 балл. 3.Правильность |
| 7.Конкурс “Юных знатоков” 3 минуты | Команда, одинаковый тест, зачитывает учитель | 2 балла | 1.Правильность ответов. 2.Каждые 3 вопроса -1балл. |
Подготовка к уроку.
- Необходимо продумать план проведения урока, какие и сколько конкурсов включать в программу урока. Это зависит от времени (можно использовать спаренные уроки) и от количества учеников в классе (увеличивается количество команд).
- Продумать шкалу оценок (баллов), чтобы суммарно максимальная оценка за урок составила 12 баллов.
- Познакомить учащихся с критериями оценивания конкурсов.
- Подготовить весь дидактический материал.
- Ученики должны повторить тему перед таким уроком.
Примечание.
Следует отметить, что урок не требует никаких предварительных репетиций. Есть смысл в проведении таких конкурсов на этапах актуализации опорных знаний, на ориентировочно-мотивационном, а также рефлексивно-оценочном. Тогда ребята будут ознакомлены с правилами проведения этих конкурсов, что сократит время на заключительном уроке.
Этот урок – соревнование очень помогает повышению интереса к изучению химии, создает положительный эмоциональный фон процесса обучения и может применяться при обобщении и систематизации знаний по другим темам школьного курса химии.
Инструкция по выполнению задания конкурса экспериментаторов
Команда № 1 (2)
- . Налейте в пробирку 0,5 мл (0,5 см по высоте) раствора соли нитрата алюминия (нитрата цинка).
- Добавьте по каплям раствор гидроксида натрия до образования белого студенистого осадка.
- Напишите на доске уравнение химической реакции, которая произошла между веществами.
- Разделите полученный осадок на 2 части: для этого перелейте (аккуратно!) часть осадка в чистую пробирку.
- К І части осадка добавьте раствор соляной кислоты.
- Напишите на доске уравнение реакции, которая произошла.
- Ко ІІ части осадка добавьте раствор гидроксида натрия до полного растворения осадка.
- Напишите на доске уравнение химической реакции.